新聞網(wǎng)訊 近日,,我校藥學(xué)院孫勇教授和中國(guó)科學(xué)院化學(xué)研究所肖海華研究員合作,,在鉑藥核靶遞送和免疫增強(qiáng)研究方面取得最新研究進(jìn)展,。相關(guān)研究成果近期以“Nuclear-Targeting Lipid PtIVProdrug Amphiphile Cooperates with siRNA for Enhanced Cancer Immunochemotherapy by Amplifying Pt-DNA Adducts and Reducing Phosphatidylserine Exposure”為題發(fā)表在Journal of the American Chemical Society(JACS,DOI:10.1021/jacs.3c12706)作為封面文章。本文第一作者為青島大學(xué)藥學(xué)院青年教師魏登帥,,通訊作者為孫勇教授和肖海華研究員,。
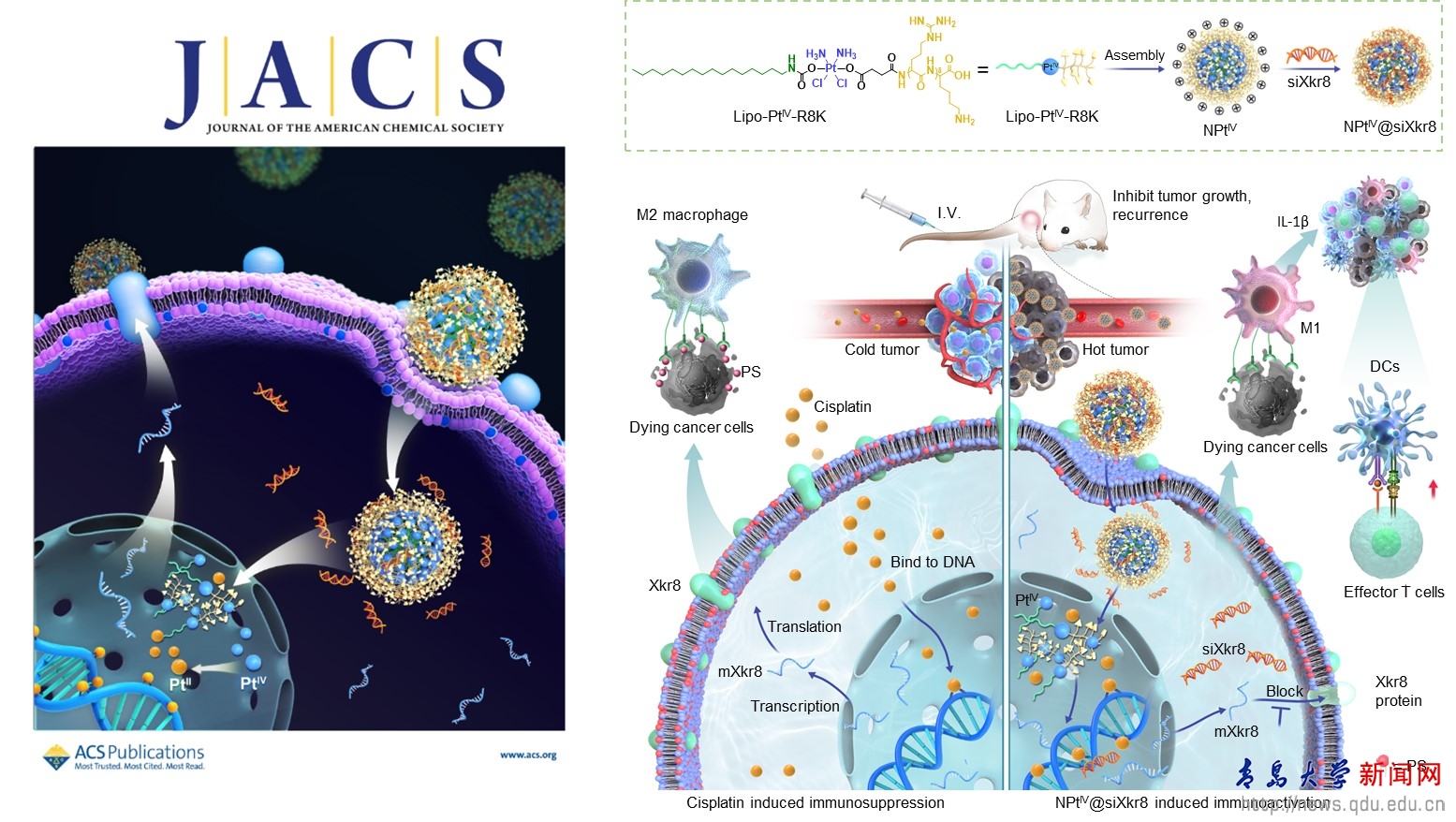
鉑類藥物已在臨床上沿用了近半個(gè)世紀(jì),至今仍在化療藥物中占據(jù)重要地位,。通過(guò)加合DNA,、阻滯DNA復(fù)制而殺傷癌細(xì)胞的鉑藥,雖在臨床取得了成功,但鉑藥治療后的病人會(huì)出現(xiàn)嚴(yán)重毒副作用和腫瘤復(fù)發(fā),。據(jù)報(bào)道,,當(dāng)鉑類藥物進(jìn)入人體后,能夠到達(dá)腫瘤部位的不足10%,。這些脫靶的鉑藥會(huì)和正常細(xì)胞的DNA或蛋白結(jié)合,,進(jìn)而使化療病人會(huì)出現(xiàn)嚴(yán)重毒副作用,如神經(jīng)和腎臟損傷,、惡心,、嘔吐、骨髓抑制等,。鉑類藥物還存在免疫效應(yīng)弱,、治療后腫瘤易復(fù)發(fā)等問(wèn)題。其中重要的原因之一是常規(guī)的化療或放療會(huì)導(dǎo)致細(xì)胞內(nèi)膜的主成分磷脂酰絲氨酸被促翻轉(zhuǎn)蛋白不可逆地外翻到癌細(xì)胞表面,。阻止磷脂酰絲氨酸被分流到癌細(xì)胞的表面,,可促進(jìn)免疫系統(tǒng)消殺化療所殘留的癌細(xì)胞,進(jìn)而防止腫瘤復(fù)發(fā),。但是到目前為止,抑制促翻轉(zhuǎn)蛋白表達(dá)的抑制劑尚未被發(fā)現(xiàn),,而通過(guò)小干擾RNA抑制促翻轉(zhuǎn)蛋白的表達(dá)是誘導(dǎo)化療免疫效應(yīng)增強(qiáng)的有效途徑,。
在國(guó)家自然科學(xué)基金委、山東省教育廳,、青島大學(xué)等的支持下,,孫勇課題組提出將結(jié)構(gòu)可調(diào)的四價(jià)鉑、生物相容性優(yōu)異的脂質(zhì),、細(xì)胞核靶向特定基元相結(jié)合的理念,,設(shè)計(jì)、合成分子精確的核靶向脂質(zhì)四價(jià)鉑載體前藥,,并用其負(fù)載siRNA以抑制促翻轉(zhuǎn)蛋白的表達(dá),,從而構(gòu)建集靶向化療、免疫增強(qiáng)相結(jié)合的治療體系,。一方面脂質(zhì)四價(jià)鉑膠束依靠自身脂質(zhì)的生物相容性以及細(xì)胞核靶向性,,靶向細(xì)胞核,實(shí)現(xiàn)鉑藥核聚集,,隨后在癌細(xì)胞高還原態(tài)的條件下,,釋放二價(jià)鉑原藥,從而與核DNA加合,,殺傷癌細(xì)胞,。另一方面,siRNA可間接的減小磷脂酰絲氨酸在癌細(xì)胞內(nèi)的分布,從而提高鉑藥化療時(shí)的免疫治療特性,??傊擉w系將有助于提高鉑藥和DNA加合率,、增強(qiáng)免疫治療效力,,對(duì)提高鉑藥的生物利用率、誘導(dǎo)免疫增強(qiáng)以及核酸藥物遞送具有重要意義,。






![]() 魯公網(wǎng)安備 37021202000856號(hào)
魯公網(wǎng)安備 37021202000856號(hào) ![]()